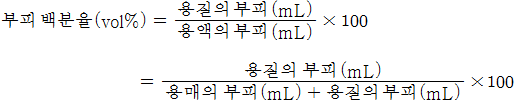인터넷이 안될 때
2014 최고의 동기부여 영상 ▶ Do it now - Motivational(4분 48초)

 • 용액의 농도에 대하여 설명할 수 있다.
• 용액의 농도에 대하여 설명할 수 있다.
• 용액의 농도를 나타내는 여러 가지 방법과 단위에 대해서 설명할 수 있다.
- 용해도
용매에 용질이 최대로 녹을 수 있는 양
- 농도
- 용매에 용질이 녹아있는 정도
- 용액 속에 함유된 용매와 용질의 조성비를나타낸 것

-
용액의 몰 수에 대한 어느 한 성분의 몰 수의 비
-
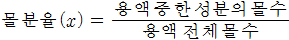

-
수소 2g, 산소 16g, 질소 14g이 들어 있는 혼합 기체에서 산소의 몰 분율을 구하시오.
-
46%(무게 백분율) 에탄올(C2H5OH) 수용액에서 에탄올의 몰 분율을 구하시오.(단, 원
자량은 C = 12, O = 16, H = 1이다.)

-
일정한 양의 용액 속에 녹아 있는 용질의 양을 백분율로 나타낸 농도
-
질량 백분율(wt%) :
-
액체에 용해된 고체의 농도 표시
-
용액 100g 속에 녹아 있는 용질의 g수

-
부피 백분율(vol%)
-
두 종류의 액체로 이루어진 용액의 농도를 표시함
-
용액 100mL 속에 녹아있는 용질의 mL 수
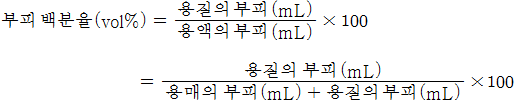
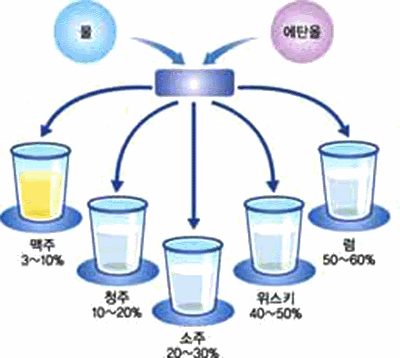
그림 Ⅱ-37 알코올 농도에 따른 술의 종류

-
물 100g에 NaCl 20g을 녹인 수용액의 질량 백분율 농도는 얼마인가?
-
물 100g에 CuSO4·5H2O 100g을 넣었다면, 이 용액의 % 농도는 얼마인가?
-
부피 백분율로 16%의 에탄올 용액을 만드는 방법을 적어 보자.


-
NaOH 4g을 물에 녹여 수용액 500mL로 만들었다. 이 용액의 몰 농도는 얼마인가?
-
포도당(C6H12O6) 용액 100mL 속에 36.0g의 포도당이 녹아 있다. 이 용액의 몰 농도는
얼마인가?(단, 포도당의 분자량은 180이다.)

-
용매 1kg 중에 용해되어 있는 용질의 mol 수

-
몰랄 농도는 기준점이 질량이므로 온도의 영향을 받지 않는다.
-
묽은 용액
의 끓는점 오름과 어는점 내림의 측정에 많이 이용

-
물 50g에 NaOH 2g을 용해시켰다. 이 용액의 몰랄 농도는 얼마인가?
-
11.7g NaCl을 100g물에 녹인 용액의 몰랄 농도는 얼마인가? (단, NaCl의 화학식량은
58.5이다.)



-
용액의 밀도(비중)를 알면 % 농도를 몰 농도와 몰랄 농도로 환산할 수 있다.
-
%
농도의 밀도(d g/mL)를 이용하여 아래와 같은 방법으로 구하면 된다.

48%의 HF을 함유한 수용액이 있다. 이 HF 수용액의 밀도가 1.59g/mL일 때 몰
농도를 구하시오. (단, H의 원자량은 1, F의 원자량은 19이다.)


-
비중이 1.84이고 무게 농도가 96%인 진한 황산(H2SO4)의 몰 농도는 얼마인가?
- 0℃에서 NaOH 50g을 물 150g에 녹인 용액의 밀도가 1.2g/mL이었다.(단, NaOH의
화학식량은 40이다.)
1) 질량 % 농도는 얼마인가?
2) 몰 농도는 얼마인가?(mol/L)
3) 몰랄 농도는 얼마인가?(mol/kg)

인터넷이 안될 때
어느 독일인의 글






 • 용액의 농도에 대하여 설명할 수 있다.
• 용액의 농도에 대하여 설명할 수 있다. 

![]()