


세상을 따뜻하게 하는 음악

 • 용해에 대하여 설명할 수 있다.
• 용해에 대하여 설명할 수 있다.
• 용해도에 대해 설명할 수 있다.
하나 이상의 물질이 다른 물질 속에 균일하게 섞여 있는 혼합물
녹이는 성분, 많이 들어 있는 성분(예: 물) (물은 항상 용매로 간주한다.)
녹아 있는 성분, 적게 들어 있는 성분 (예: 소금)


다음의 그림 자료를 보고 NaCl과 설탕 입자의 물에 대한 용해에서 차이점을 탐구해 보자.
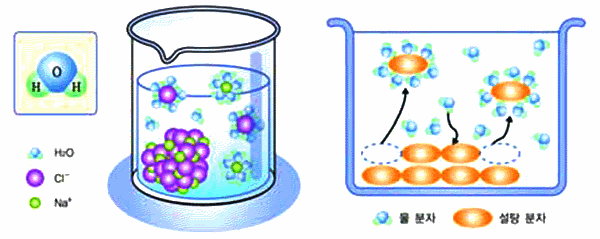
그림 Ⅱ-25 NaCl과 설탕의 용해
![]()

그림 Ⅱ-26 이온의 수화[Cl-(aq), Na+(aq)]
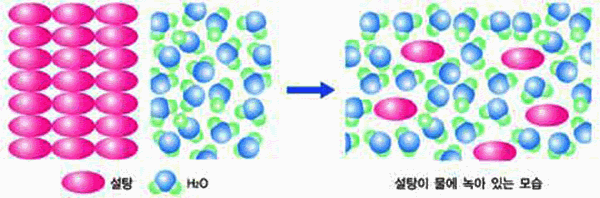
그림 Ⅱ-27 설탕의 용해
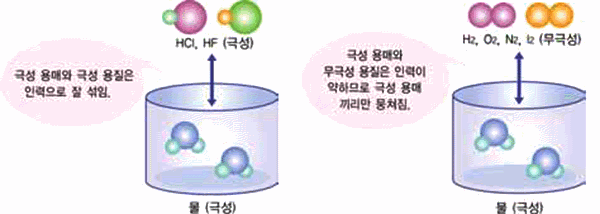
그림 Ⅱ-28 극성 용매와 극성 용질 그림 Ⅱ-29 극성 용매에 무극성 용질
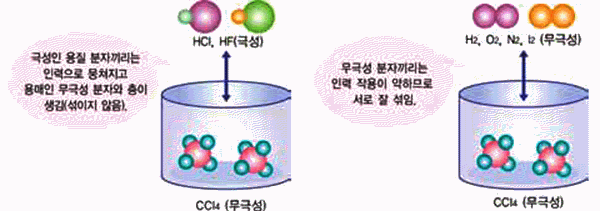
그림 Ⅱ-30 무극성 용매에 극성 용질 그림 Ⅱ-31 무극성 용매에 무극성 용질

① 물(H2O)
② 벤젠(C6H6)
③ 암모니아(NH3)
④ 염산(HCl)
⑤ 에탄올(C2H5OH)
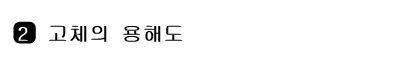

다음의 그림 자료를 보고, 고체 물질들의 용해도를 탐구해 보자.
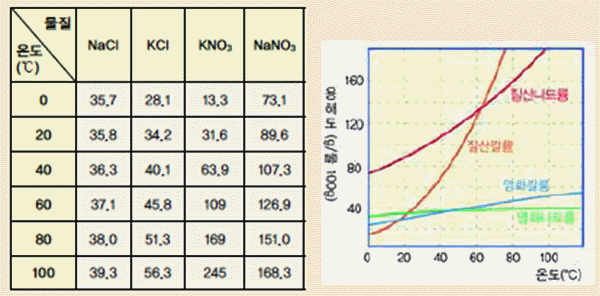
그림 Ⅱ-32 여러 가지 물질들의 온도에 따른 용해도와 용해도 곡선
![]()
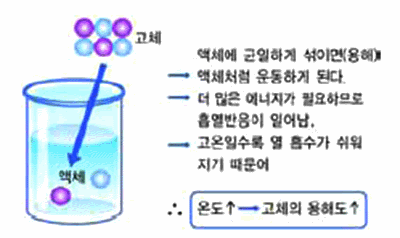
그림 Ⅱ-33 고체의 온도와 용해도와의 관계
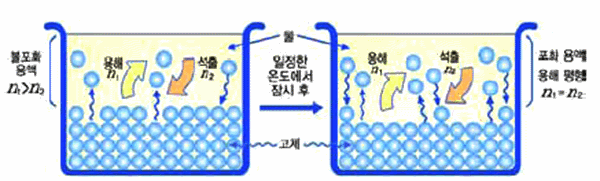
그림 Ⅱ-34 용해 평형 [ ![]() : 용해되는 입자 수,
: 용해되는 입자 수, ![]() : 석출되는 입자 수]
: 석출되는 입자 수]



다음의 자료들을 보고, 기체 물질들의 용해도에 대해 탐구해 보자.
표 Ⅱ-4 각 온도에서 기체의 용해도
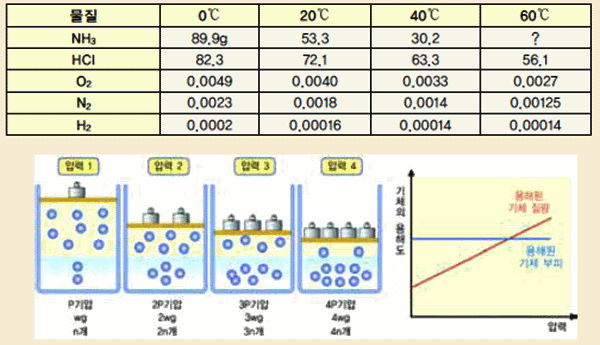
그림 Ⅱ-35 헨리의 실험
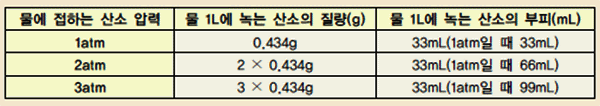
표 Ⅱ-5 물 1L에 녹는 산소의 질량과 부피
![]()
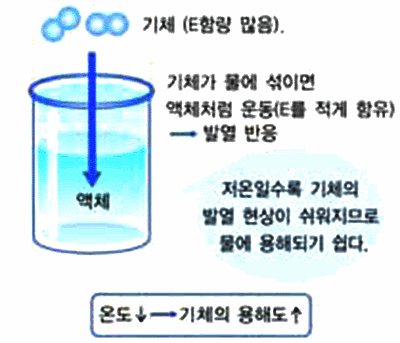
그림 Ⅱ-36 기체의 온도와 용해도와의 관계

수심이 깊어지면 수압이 높아진다. 그 결과 잠수부의 몸 조직 내의 질소(N2) 중 일부가 혈액 속으로 녹아 들어 간다. 만약 잠수부가 깊은 수심으로부터 급히 올라오면 몸에 받고 있던 수압이 갑자기 감소되어 혈액 중에 기포 가 생기게 되고, 이 기포가 관절과 골수 속에 모이게 되 어 심한 통증을 주게 된다. 이것을 잠수병이라고 한다. 이 병은 보통 상태로는 치명적인 것이 아니지만, 만약 기포가 골수나 척수에 모이게 되면, 생명이 위험하게 된다. 잠수병에 걸린 잠수 부를 고압실에 넣고, 일정한 압력 하에 두면, 기포는 다시 혈액 중에 용해되어 버린다. 그 다음 서서히 압력을 낮추어 정상 기압이 되면, 혈액 중에 과포화 상 태로 있던 질소는 서서히 폐를 통하여 방출되고 병은 치료된다. 그러므로 잠수부가 잠수 후에 중간 중간 쉬면서 천천히 올라 온다면, 혈액 중에 용존되어 있는 질소(N2)가 허파를 통하여 방출되어 버리고 기포로서 유리되지 않 을 정도로 서서히 정상 압력 상태로 돌아오게 되므로, 잠수병에 걸리지 않게 된다.

사랑해요 어머니(I Love you, Mom)(5분 24초)