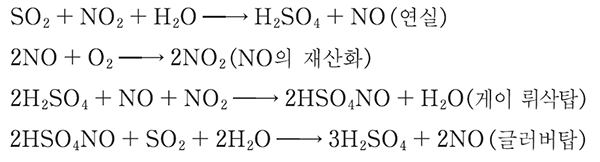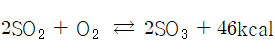주소가 19금


-
황산 공업의 발달
-
18세기 이전 : 황화철( FeS2)을 자연 산화시켜 황산제이철( FeSO4·7H2O) 가열, 분해하여 황산 제조
-
1746년 : 영국에서 초기의 연실식 황산 공종 설립(대량 생산)
-
1823년 : 르블랑법 탄산나트륨 공업 번성(황산 수요 급증)
-
1829년 : 흡수탑(게이 뤼삭탑) 발명(질소 산화물 흡수)
-
1859년 글러버(Glover)탑 발명(흡수탑의 함질 황산 분해), 연실식(lead chamver process) 황산 제조법 완성(제품 순도, 농도 저하로 탑식, 반탑식으로 개선)
-
19세기 : 접촉식(contact process) 황산 제조법 개발(이산화 황을 백금 촉매 아래에서 산화시켜 고농도 황산 제조)
-
1914년 : 백금 촉매를 오산화바나듐(V2O5을) 촉매로 대체(독일 BASF사 개발)
-
현재 : 국내에서는 아연, 구리, 철 등의 금속 제련소 재출 가스 중의 이산화 황을 원료로 황산 제조(접촉식)
1) 개요
-
황산(sulfuric acid, H2S04)은 화학 공업의 기초 원료로서 그 자체 공업으로서도 중요한 화학공엽
-
금속 제련, 제강, 방직, 제지, 식품 등의 각종 공업에 광범위하게 사용되고 있으며, 이 밖에 실험실용 시약, 의약품으로서의 용도로도 많이사용
2) 황산의 성질과 용도
-
100% 황산은 무색으로 점도가 크고 무거운 액체, 순도가 96 ~ 98%인 것은 비중이 1.84종도
-
진한 황산(약 90% 이상)은 흡습성이 있으며, 탈수 작용이 강하여 다른 화합물 속의 수소와 산소를 물의 성분비로 탈수
-
가열한 진한 황산은 산화 작용, 구리, 수은, 은 등과 반응하여 이산화황을 발생
-
묽은 황산(약 90% 미만)은 흡습성, 탈수성 및 산화성이 없으며, 강한 산성을 나타내고 아연, 철 등과 반응하여 수소를 발생
-
삼산화황이 물과 결합하면 mSO3·H2O
-
m = n,100% 황산 (= H2SO4)
-
m < n, 황산 수화물
-
m > n, 발연 황산, 공기 중에 노출되면 흰색 연기 발생
Ⅱ-2 황산은 분자 모형 및 황산 용액
Ⅱ-2 황산의 명칭과 용도
|
명칭
|
H2S04(%)
|
용도
|
|
묽은 황산
|
60~80
|
비료, 섬유, 무기약품, 철강, 산세척
|
|
진한 황산
|
90~100
|
비료, 섬유, 석유 정제, 농약, 금속 제련
|
|
정제된 황산
|
90~100
|
축전지, 무기약품, 의약품, 섬유, 농약, 시약, 석유정제
|
|
발연 황산
|
유리 S03 13~35
|
화약, 도료, 유기합성
|
3) 황산의 제조
-
황산의 제조 공정
-
이산화 황 제조 공정 : 황 또는 황화물 원료를 배소
S + O2 → SO2
-
전화 공정 : 이산화 황을 삼산화 황으로 산화
2SO2 + O → 2SO3
-
흡수 공정 : 삼산화 황을 물 흡수
SO3 + H2O → H2SO4

Ⅱ-3 황산의 제조 과정
① 이산화 황(SO2)의 제조 공정
-
황산을 제조하려면 먼저 황을 연소시키거나 황화광을 배소(roasting)시켜 이산화 황 가스를발생
㉠ 원료
-
황산은 이산화 황을 주 원료로 사용하여 제조하므로 연소시켰을 때 이산화 황을 발생시키는 것은 모두 원료로 사용 가능
-
황을 직접 연소하는 방법도 있지만, 최근에는 각종 제련소, 중유 연소 및 석유를 정제할 때 발생하는 폐가스 등에 함유되어 있는 이산화 황을 원료로 이용하는 경우가 대부분
-
우리 나라에서 생산되고 있는 황산은 대부분은 황화광으로 금속을 제련할 때 발생하는 이산화 황을 원료로 이용
-
황화광에는 황철광(FeS2), 자황철광(FeS), 섬아연광(Zns), 황동광(CuFeS2), 방연광(PbS) 등
-
광물을 제련할 때 나오는 배출 가스 중에는 이산화 황이 포함되어 있어 대기 중에 그대로 배출하면 산성비의 원인, 이를 회수하여 황산의 원료로 사용하면 대기 오염 감소
㉡ 황의 연소(combustion)
-
황은 대부분 99% 이상의 높은 순도를 가지고 있어서 이산화 황의 제조 원료로서 가장 적합하지만, 황화 수소를 직접 연소시키는 방법도 있다.
-
연소로에서는 연소 가스의 온도가 700~1500 ℃ 정도 되므로 이 높은 열은 다음 공정에 이용하기 위해 열교환기(폐열보일러)로 회수
㉢ 황화 광의 배소
-
황회광의 배소에서는 예부터 원통형의 기계로인 다단 배소로(multiple hearth roaster)가 이용되어 왔으며, 회전로나 플래시로(flash roaster)도 이용
-
최근에는 유동 배소로(fluidized bed roaster)가 많이 사용되고 있으며 소성 온도는 모두 800 ~ 900℃
-
연소 가스 중의 이산화 황(S02)은 7~ 10% 정도
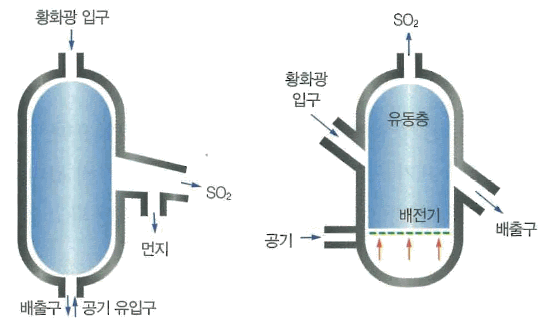
그림 Ⅱ-4 플래시로 그림 Ⅱ-5 유동 배소로
- 유동층 : 용기 속의 미립자 나 가루로 되어 있는 재료들이 액체 또는 기체의 유속에 따라 이동하는 층
- 배전기 : 점화 코일에 발생한 높은 전력을 점화 순서에 따라 각 점화 플러그에 배전하는 기기
- 연실 : 납을 입힌 큰 용적의용기
|
② 이산화 황의 전화 공정 및 삼산화 항의 흡수 공정
-
발열 반응이고 가역 반응인 배소 공정으로 제조한 이산화 황을 산화시켜 삼산화 황을 만든 후 진한 황산에 흡수시켜 황산 제조
-
제조 방법에는연실식과 접촉식
㉠ 연실식 (lead chamber process)에 의한 황산 제조 방법
-
질소 산화물을 산소 공급 촉매로 이용하여 물과 이산화 황을 반응시켜 황산을 만들고, 생성된 일산화 질소(NO)는 공기 중의 산소아 반응하여 이산화 질소로 재산화
-
질소 산화물은 산소를 공급하는 역활을 담당
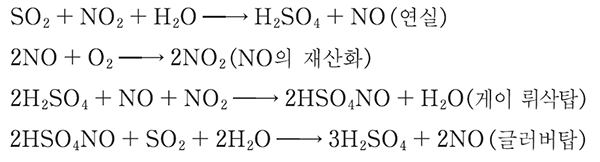
-
게이 뤼삭탑에 생성된 함질 황산(nitrosyl sulfuric acdi, HSO4NO)은 연실식 황산 제조법의 중요한 중간 생성물로서 60 ~80% 황산 중에는 용해된 이산화 황을 쉽게 산화하여 황산을 생성
-
이 반응은 주로 연실이나 탑에서 일어나며 일부 글러법탑에서도 일어남.
-
연실식으로 제조된 황산은 불순물이 많아 순도와 농도가 낮아서 현재 잘사용 되지 않음
㉡ 접촉법에 의한 황산 제조 방법
-
접촉식은 이산화황과 이것의 산화생성물인 삼산화황 사이의 평형에 기본
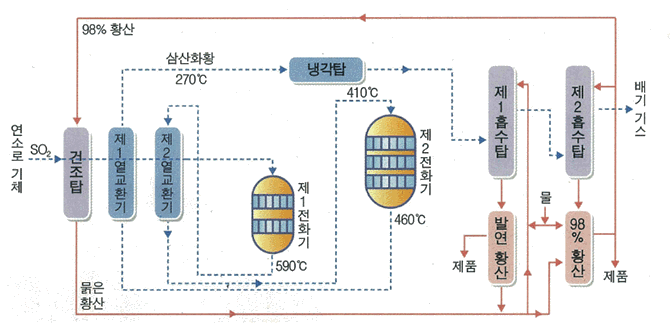
그림 Ⅱ-6 접촉식에 의한 황산의 제조 공정(---은 가스 경로)
-
이 반응은 발열 반응이기 때문에 반응을 생성물 쪽으로 이동시키기 위해 기능한 한 낮은 온도에서 반응이 진행
-
반응 온도가 낮아지면 반응 속도가 느려져 생성물의 생성량이 적어지는 문제가 발생
-
이러한 경우 촉매가 필요하며 촉매는 낮은 쪽 반응 최적 온도에서 반응 속도를빠르게 하여 생성량을 증가
-
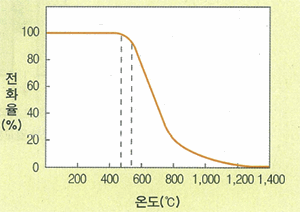
그림 Ⅱ-7에서 보면 가급적 저온에서 반응시키는 것이 좋다는 것을 알 수 있다. 그러나 온도와 반응 속도를 함께 고려해야 하기 때문에 실제로는 450~500℃ 상압에서 반응시키는데, 이때 전화율은 97~98% 정도
-
이산화황의 전화 촉매로는 오산화바나륨(V205)을 주촉매로, 황산칼륨(K2S04)을 조촉매로, 실리카켈이나 규조토를 담체로 하여 구성 그림 Ⅱ-7 전화율과 온도 관계
-
담체의 역할 : 촉매의 표면적을 크게 하여 기상 반응물과 촉매의 접촉 면적을 증대시키고 촉매의 입자가 쉽게 깨어지지 않도록 강도를 부여
-
조촉매를 사용하지 않고 오산화바나륨만을 촉매로 사용하면 전화율은 약 22%이지만, 조촉매를 사용하면 98%까지 향상
-
제조 공정 및 장치
-
황산 제조에 있어서 접촉식의 중요한 공정에는 배소, 가스의 정제, 이산화 황의 전화 및 생성된 삼산화 황을 진한 황산에 흡수시키는 방법 등의 세가지 화학적 공정
-
흡수탑
-
흡수탑에서 진행되는 공정은 전화기에서 생성된 삼산화 황을 발연 황산흡수탑이나 진한 황산 흡수탑에 흡수시켜 발연 황산이나 진한 황산을 제조하는 공정
-
전화기
-
전화기(converter)에서는 이산화 황을 삼산화황으로 산화시킨다. 이 반응은 발열 반응이기 때문에 원료인 이산화황을 적당히 예열하여 온도의 급작스런 상승을 피하고, 촉매를 최적 온도에서 보호하도록 하는 것이매우 중요
-
전화기에는 내부 열교환식과 외부 열교환식
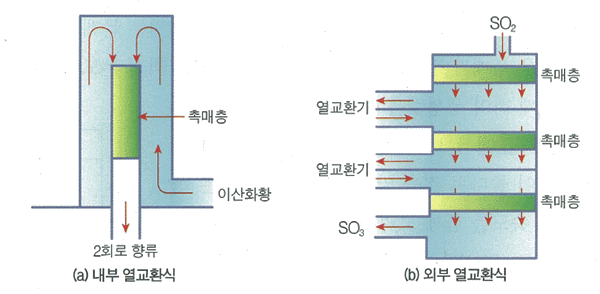
그림 Ⅱ-8 전화기의 종류

2016 동기부여 영상 - 독립