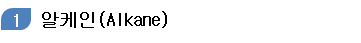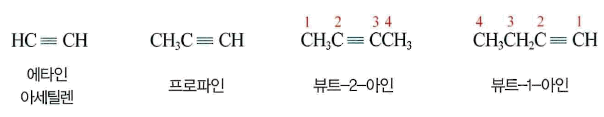순수한 손님 - (레전드사연 UCC 애니메이션) 3분 38초
02 유기 화합물의 분류.gif)
(1) 유기 화합물의 분류
- 유기 화합물 : 탄화수소와 탄화수소 유도체 로 분류
- 탄화수소(hydrocarbon) : 유기 화합물중에서 탄소(c)와 수소(H)만으로 이루어진 화합물
- 탄소-탄소 사이의 결합 상태에 따라 포화 탄화수소와 불포화 탄화수소 구분
- 포화 탄화수소는 탄소-탄소 사이의 결합이 단일 결합
- 불포화 탄화수소는 탄소-탄소 사이의 결합이 이중 결합 또는 삼중 결합
- 탄화수소 유도체 : 탄화수소의 수소 원자가 다른 원자나 원자단으로 치환된 화합물
- 탄화수소는 결합 형태에 따라 사슬 모양 탄회수소와 고리 모양 탄화수소로 구분
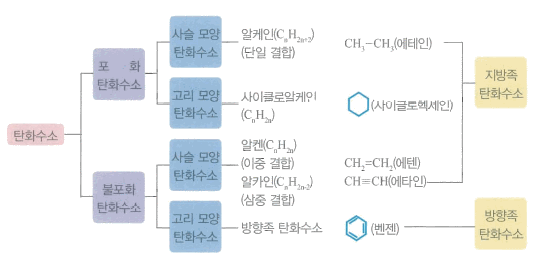
그림 1 탄화수소의 분류
- 사슬 모양 탄화수소 : 구조 중에 고리가 없고 구성 원자들이 사슬 모양으로 결합하고 있는 화합물
- 고리 모양 탄화수소는 탄소 원자들이 고리 모양으로 결합한 것
- 포화 탄화수소 : 탄소 결합이 모두 단일 결합
- 불포화 탄화수소 : 벤젠 고리를 포함하는 탄화수소
- 지방족 탄회수소 : 탄화수소 중 사슬 모양 탄회수소와 고리 모양 탄화수소는 ,
- 방향족 탄화수소 : 분자 내에 벤젠 고리를 포함하는 불포화 탄화수소
(2) 포화 탄화수소
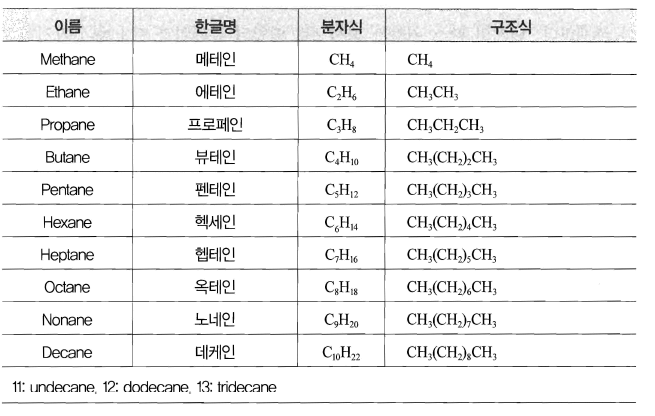
- 포화 탄화수소 : 탄소와 탄소 사이의 결합이 단일 결합만으로 이루어진 탄화수소, 파라핀 (paraffin)계 탄회수소
① 알케인의 구조와 성질
- 탄소 원자 사이의 결합이 단일 결협만으로 이루어진 사슬 모양의 포화 탄화수소로 일반식은

- 탄소 수가 많을수록 분자간의 인력이 커서 녹는점, 끓는점이 높아진다.
- 탄소-탄소 단일 결합에 의해 세 개, 네 개,, 다섯 개 또는 그보다 많은 수의 탄소 원지들이 서로 연결되었다고 가정해 보면 알케인이라고 부르는 분자의 큰 계열을 만들 수 있다.
- 상온에서 탄소 수가 4개 이하이면 기체 상태로 5 ~ 15개이면 액체 상태로, 16개 이상의 알케인은 고체 상태로 존재
-
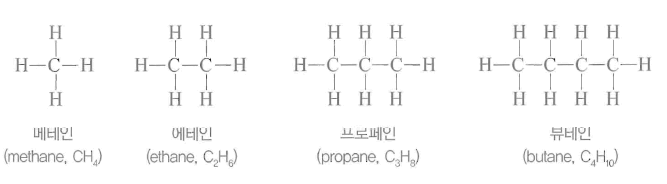
가장 간단한 탄소 화합물로 1개의 탄소 원자에 수소 원자 4개가 결합된 정사면체 구조로 탄소 원자와 수소 원자의 결합각은 109.50
-
공기보다 가벼운 기체이며, 연소하면 많은 열이 발생하므로 도시가스(LNG)로 이용
-
순수한 메테인은 냄새가 없지만 산업용으로 시용할 때에는 누출을 발견하기 쉽도록 냄새가 나는 다른 화합물이 첨가
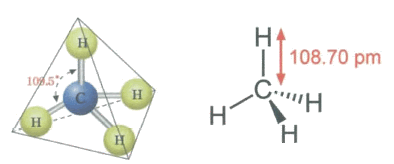
그림 2 메테인의 분자 모형 및 구조식
-
에테인, 프로페인, 뷰테인의 구조
-
알케인 중에서 탄소가 2개인 것을 에테인 (ethane, C2H6) , 탄소가 3개인 것을 프로테인(propane, C3H6) , 탄소가 4개인 것을 뷰테인 (butane, C4H10)이라 부르며, 화학적인 성질도 비슷하다.
-
뷰태인의 경우는 분자식 ( C4H10)은 같지만 구조가 다른 구조 이성질체가 존재
-
네개의 탄소 원자기- 직선으로 배열된 뷰태인과 탄소들이 가지를 이루고있는 아이소뷰테인 두 종류의 구조 이성질체가 존재하는데, 이들은 끓는점, 녹는점, 밀도 등의 성질이 각각 다르다.
-
탄소 수가 증가함에 따라 동일한 분자식이나 구조가 서로 다른 이성질체의 수는 증가
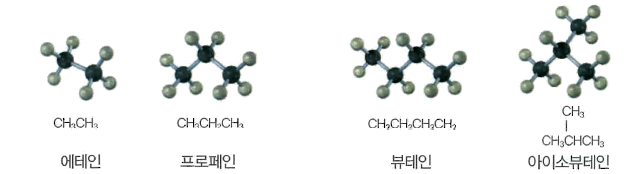
그림 3 간단한 알케인류의 구조식
-
알케인의 성질
-
화학적으로 안정하여 반응성이 작으나 할로젠 원소(F, Cl, Br)외순 치환 반응
-
알케인의 반응 중 가장 흔한 반응은 연소 반응이며. 연소 시 이산화 탄소와 물이 생성, . 이때 많은 열에너지가 빙출되므로 탄소 수가 적은 알케인은 연료로 사용
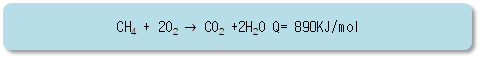
② 알케인의 명명법
- 알려진 순수한 유기 화합물의 수가 비교적 적었던 초기에는 새로운 화합물의 이름은 발견자의 순간적인 생각에 따라 명명
- 요소는 소변에서 분리된 순수한 결정성 물질이고, 모르핀 (morphine , CH17H19N03)은 그리스의 꿈의 신인 모르페우스(Mopheus)의 이름을 따서 명명된 진통제
- 19세기에 들어서서 유기 화학이 본격적으로 발전하게 되면서 수많은 화합물이 알려지게 되었고, 그 화합물들을 명명할 수 있는 체계적인 방법이 필요하게 되었다.
- 국제 순수 · 응용 화학 연합(IUPAC: International Union of Pure and Applied Chemistry) 이 정한 화합물 명명법인 IUPAC 명 명법을 사용하고 있으며, 대한 화학회에서도 이 명명법을 한국어 체계에 맞게 재규정하여 사용
- 포화 탄화수소
- 탄소수들 나타내는 그리스어 숫자의 접두어에 접미어 ‘ ane'을 붙여 명명
- 한글명은 그리 스어 숫자의 접두어에 접미어 ‘-에인’을 붙여 명명
- 널리 사용되고 있는메테인부터 옥태인 (octane)까지의 경우에는 당분간‘-ane’을 ‘안’으로 적는 것을 허용한다(1998, 대한화학회 유기 화합물명명 규칙)
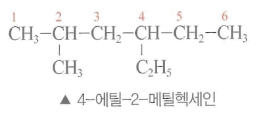
- 가지 달린 화합물
- 가장 긴 사슬을 기본명으로 하여 가지의 위치가 작은 번호가 되도록 탄소 원자에 아라비아 숫자를 붙여서 결합 위치 수-명칭을 기본명 앞에 붙여서 부른다.
- 주사슬에 붙은 집단을 치환기 (substituents) 라 하고, 포화 탄화수소의 치환기는 알킬기 (alkyl group)라 한다.
- 알킬기는 알케인에서 수소 원자한 개를 떼어낸 원자단으로 알케인의 이름에서 어미 ‘- ane’ 대신에 ‘ -yl’을 붙여 명명하고 R로 표시
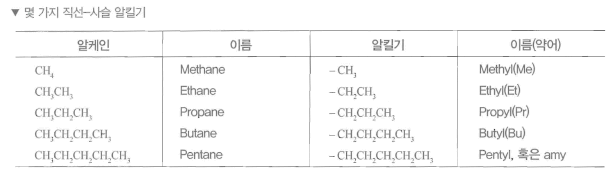
- 2개 이상의 동일 치환기가 주사슬에 연결되어 있으띤 다이 (di-), 트라이(tri-), 테트라(tetra-) 등의 접두어를 사용
- 숫자와 숫자 사이에는 쉽표를 넣고, 숫자와 문자 사이에는 hyphen(-)을 사용하며, 마지막 치환기 이름과 기본 알케인의 이름은 붙여서 쓴다.
- 만일 2 개 이성의 다른 종류의 치환기가 존재하면 얄파벳순으로 배열히며, 이때 di-, tri-, tetra- 등의 접두어는 알파뱃 순서 를 고려하지 않는다. 그리고 치환기 이름이 알파뱃 순서 규칙에 우선히는 쪽에 작은 번호를 붙인다.
- 하이픈(hyphen)으로 연결된 2차(sec-), 3차(tert~)와 같은 접두어는 얄파벳 순서에 고려하지 않으나, 접두어 아이소(iso)는 하이픈을 붙인 접두어가 아니며 알파벳 순서에 포함
① 사이크로알케인의 구조와 성질
- 여러 개의 탄소 원자가 고리처럼 결합해 있고 단일 결합으로 이루어진 포화 탄화수소이며, 일반식은 CnH2n
- 비교적 비활성이며 치환 반응, 탄소 수가 작은 사이클로알케인(사이클로프로페인, 시이클로뷰태인)의 경우 결합각이 정상적인 109.5˚ 정사면체값으로부터 벗어나 결합각 스트레인에 의해 불안정하여 첨가 반응을 일으켜 사슬 모양으로 되기도 한다.
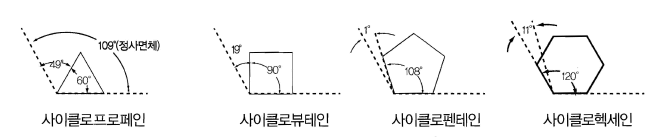
그림 간단한 사이클로알케인류의 결합각
- 사이클로펜테인은 오각형의 결합각(108˚) 이 사면체의 결합각과 가장 유사하여 거의 평면 구조를 가지며 안정적
- 치환된 사이클로헥세인은 자연에 광범위하게 존재하며 가장 일반적인 사이클로알케인
- 사이클로헥세인은 109.5˚와 비교하여 평면육각형일때의 결합각(120˚)이 다르기 때문에 평면 고리가 이를 피하기 위하여 휘어져서 평면 구조에서 벗어남
- 6개의 C원자가 109.5˚의 안정한 결합각을 유지하기 위하여 평면에 있지 않고 모양은 의자모양과 배 모양의 두가지 형태
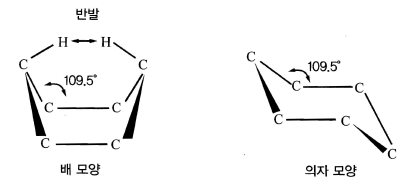
그림 사이클로헥세인의 입체 구조
② 사이클로알케인의 명명법
- 사이클로알케인은 고리를 만드는 탄소 수의 알케인 이름 앞에 접두어 ‘사이클로 (cyclo-)’를 붙여 명명
- 탄소가 3개인 것을 사이클로프로페인(cyclopropane), 4개인 것을 사이클로뷰태인(cyclobutane), 5개인 것을 사이클로펜테인 (cyclopentane), 6개인 것을 사이클로헥세인 (cyclohexane)
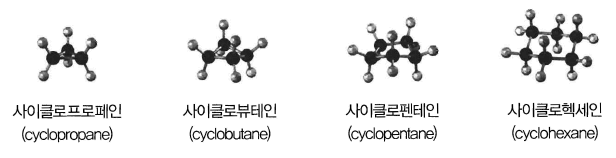
그림 간단한 사이클로알케인류의 구조식
- 치환기가 있을 경우 명명법
- 치환기가 있는 탄소를 1번으로 한다(단 치환기가 한 개인 경우 이름 앞에 1은 생략)
- 치환기가 두 개인 경우 두 개의 치환기의 숫자가 낮은 번호가 되도록 명명
- 두 개의 다른 치환기의 경우 알파뱃이 먼저 오는 것을 1번
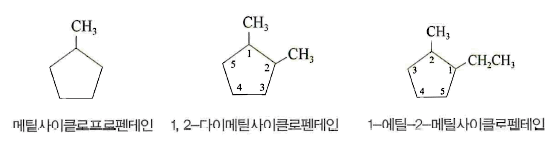
(3) 불포화 탄화수소
- 분자 내에 탄소 원자 간에 이중 결합(C=C) 또는 삼중 결합(C≡C)을 포함하는 탄화수소 화합물
- 이중 결합을 포함한 것을 알켄(alkene), 삼중결합을 포함한 것을 알카인 (alkyne)

- 가장 간단한 알겐인 ethylene과 propylene은 공업적으로 생산되는 가장 중요한 유기 화합물
- polyethylene, poypropylene, ethylene glycol, acetic acid, acetaldehyde 및 많은 수의 다른 원료 물질의 합성에 사용
① 알켄의 구조와 성질
- 탄소 원자 사이에 이중 결합(C=C)을 가진 사슬 모양의 불포화 탄회수소, 에틸렌계라고도 하며 일반식은 CnH2n의 형태를 갖는다.
- 이중 결합이 끊어지띤서 탄소 원자에 다른 원자나 원자단이 결합하는 첨가 반응 및 중합 반응을 일으켜 다양한 형태의 화합물을 제조
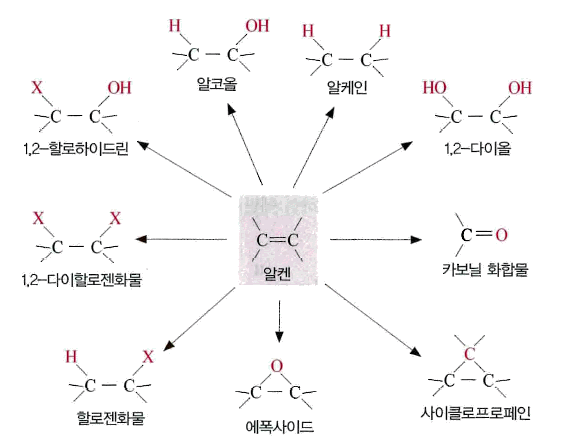
그림 알켄류로부터 제조될 수 있는 다양한 형태의 화합물
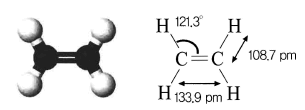
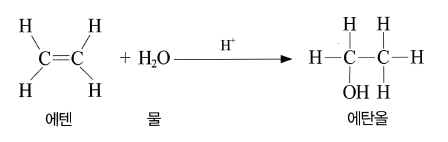
- 에텐의 분자 구조
- 에텐(C2H4, 관용명 : 에틸렌)은 가장 간단한 구조를 가진 알켄계 탄화수소
- 다른 화합물 합성의 원료로 사용
- 분자를 구성하는 원자는 모두 한 평면에 위치하며 결합각은 120˚에 가깝다.
- 상온에서는 무색의 기체로 냄새가 나며 인화성
- 에텐의 반응
- 이중 결합의 존재로 인한 높은 반응성으로 인하여 여러 가지 반응에서 중요한 역할
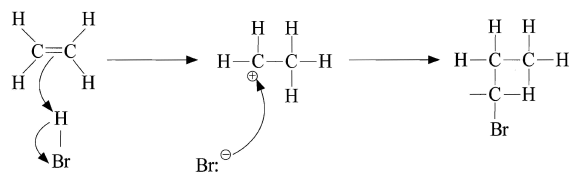
- 대표적인 반응
- 할로젠화 반응 : 할로젠과 첨가 반응하여 할로젠 화합물 생성
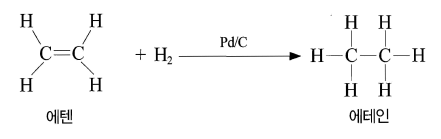
- 수소 첨가 반응 : 수소와 촉매하에 반응하여 에텐 생성
- 물 첨가 반응 : 물과 첨가 반응을 하여 에탄올을 내놓는다.
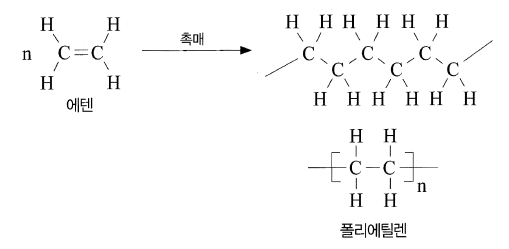
- 중합 반응 : 작은 분자가 연속적으로 반응하여 반복된 결합에 의해 큰 분자를 이루는 것을 중합, 이중 결합을 가지고 있는 화합물이 첨가 반응에 의해 중합되는 것을 첨가 중합, 에텐은 첨가 중합에 의해 폴리에틸렌 생성
② 알켄의 명명법
- 탄소 수를 나타내는 그리스어 숫자의 접두어에 접미어 ‘ 엔(-ene)’을붙이는데 탄소가 2개인 것을 에텐(ethene), 3개인 것을 프로펜(propene), 4개인 것을 뷰텐(butene), 5개인 것을 펜템(pentene)
- 석유 화학 공업의 주요한 원료로 역사적인 이유 때문에 몇 가지 알켄은 명명법 규칙에 따르지 않는 관용명 가짐
- 에테인(ethane)과 프로페인(propane)으로부터 각각 유도된 알켄은 에텐(ethene)과 프로펜(propene)으로 부르는 것이 적합하지만, 에틸렌(ethylene)과 프로필렌(propylene)으로 불러왔기 때문에 IUPAC에서도 이의 사용을 인정
- 알켄 (alkene) 의 명명법은 이중 결합을 포힘하는 가장 긴 곧은 사슬에 접미어 '-ene’을 붙여서 명명
- 포화 탄화수소의 어미 ‘에인(-ane)’을 ‘엔(-ene)’으로 바꾸어 명명
- 둘 이상의 이중 결합이 았으면 그 위치를 변호로 지정하고 어미에 diene, -triene 등으로 명명
- 다중 결합을 포함한 가장 긴 탄소 사슬을 기본명으로 하고 다중 결합의 탄소 원자의 번호가 작도록 한다.

- 만일 이중 결합이 사슴 양쪽에서 같은 거리에 였으면서 가지가 달려 있으면 가지가달린 탄소의 번호가 최소가 되도록

- 2개 이상의 다중 결합이 있을 때에는 첫 번째 다중 결합의 탄소 원자가 작은 번호가 되도록

- 고리 탄화수소에서 는 다중 결합을 기진 탄소부티 번호를 붙임
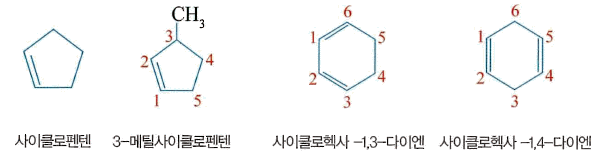
- 1cyclopentene : 한 가지 구조만 가능하므로 번호가 펼요없다.
- 3- methylcyclopentene : 이중 결합에서 변호를 시작하되 이중 결합이 포함되게 한다.
- 5-methylcyclopentene이나 1l-methylcyclopentene이 아님.
- 탄소와 탄소 원자 사이에 삼중 결합(C≡C)을 갖고 있는 사슬 모양의 불포화 탄화수소, 아세틸렌계라고도 하며 일반식은 CnH2n-2
① 알카인의 구조와 성질
- 삼중 결합을 하는 탄소 탄소 원자와 탄소에 결합된 두 원지는 동일한 직선상에 존재
- 불포화 탄회수소이기 때문에 첨가 반응과 중합 반응을 하며, 삼중 결합에는 다량의 에너지가 포함되어 있어 이중 결합의 얄켄보다 반응성이 크다.
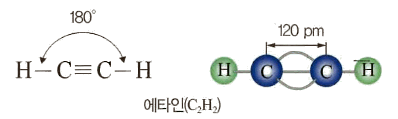
- 알카인계 탄화수소 중 가장 간단한 헝태의 화합물은 에타인(C2H2)
- 에타인은 상온에서 무색 무취의 기체 상태 로 존재하며, 열역학적으로 불안정하고, 연소 시에 매우 많은 열을 내놓기 때문에 용접 등 높은 온도가 필요한 작업에서 주로 사용
② 알카인의 명명법
- 탄소 수를 나티내는말의 어미에 ‘-아인 (-yne’)을 붙이는 것을 제외하면 알카인은 알켄처럼 명명
- 알카인 중 탄소가 2개인 것을 에테인 (ethyne, 관용명: acetylene), 3개 인 것을 프로파인(propyne), 4개인 것을 뷰타인(butyne), 5개인 것을 펜타인(pentyne)
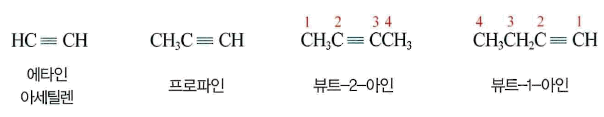
- 탄소 사슬에 있는 어떤 치환기보다 삼중 결합이 위치 변호에 우선 순위, 명명할 때 삼중 결합에 가능한 낮은 번호 부여
① 벤젠(benzene, C6H6)의 구조와 성질
- 6개의 탄소와 6개의 수소로 이루어진 고리 모양의 불포화 탄화수소
- 탄소 원자들 사이의 결합은 단일 결합과 이중 결합의 중간인 공명 구조로 평면 정육각형 구조
- 공명 구조라는 것은 두 구조의 혼성을 의미 즉, 두 구조의 물질이 혼합된 상태
- 모든 탄소-탄소 결합의 길이가 같으며, 단일 결합과 이중 결합의 중간 결합 길이
- 6개의 탄소-탄소 결합각이 120˚로 전자 밀도가 동일하고, 공영 구조 때문에 보편적인 알켄보다 더 안정하고, 반응성은떨어진다
- 벤젠은 독특한 냄새가 나는 휘발성과 인화성이 강한 액체로 발암성
- 무극성 물질로 물에 녹지 않고 알코올, 에테르, 아세톤 등에 잘 녹으며, 여러 가지 탄소화합물을 잘 용해하여 유기 용매로 널리 사용

② 방향족 화합물의 명명법
- 단일치환체 : 벤젠의 1치환체들은 벤젠 앞에 치환기의 이름을 붙여서 명명
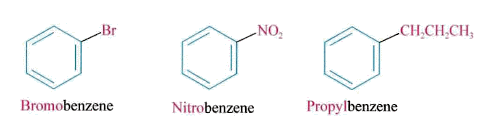
- 2치환체 : 벤젠의 2 치환체 는 치환된 위치에 따라 오쏘 (ortho-) , 메타 (meta- ), .파라(para-)라는 접두어를 사용
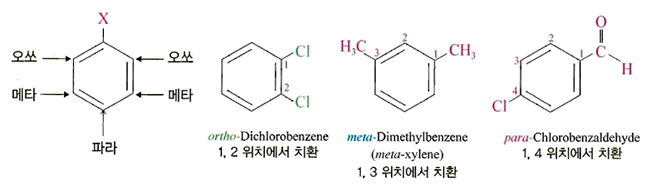
- 3개 이상의 치환기 : 치환기의 위치를 숫자로 표시하되 번호가 최소가 되게 하고 치환기 는 알파뱃 순서로 명명, 이때 관용명으로 부를 수 있는 것은 다른 치환기를 우선 명명하고 관용명을 뒤에 붙여서 명명
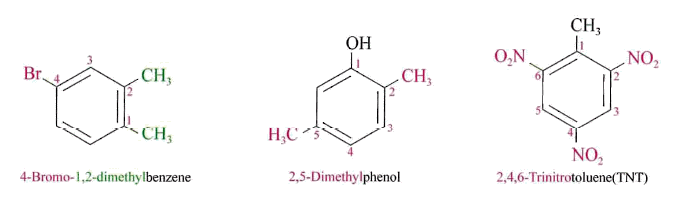
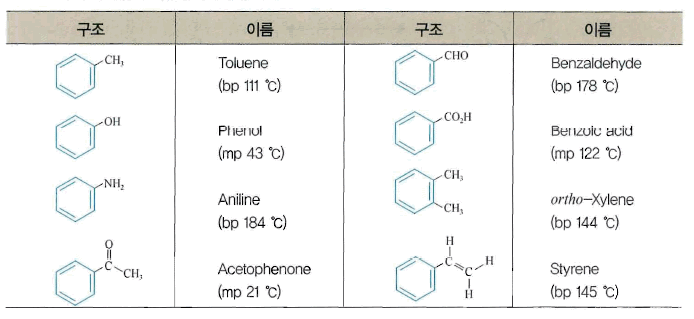
- 관용명 : 방향족 화합물은 명명법이 체계화되기 이전에 널리 사용되었기 때문에 관용명과 IUPAC명이 함께 사용
표 몇 가지 방향족 화합물의 관용명

삶의 지혜를 전하는 사자교훈_철저마침
3 분 19초





02 유기 화합물의 분류.gif)