

우리 아가씨 좀 구해주세요!! 3분 11초

- 증류 : 액체 혼합물에 열을 가해서 혼합물을 구성하는 성분들의 끓는점 차이률 이용해서 물질을 분리하는 작업
- 낮은 끓는점을 가지는 물질이 다른 물질보다 먼저 증발하게 되는데 발생한 증기를 별도로 모으고 이를 냉각시켜 액체 상태로 되돌리면 끓는점이 낮은 물질의 농도가 높은 액체를 얻을 수 있다.
- 2종 이상의 휘발성분이 포함된 액체 혼합물을 가열하면 그 증기의 조성은 액체일 때보다 휘발성이 높은 성분의 함량이 훨씬 많다.
- 화학 공업의 증류 공정에서는 대량의 제품을 연속 생산하며 공정의 제어 방식과 운전 조작이 매우 복잡하고 고도의 기술을 필요
(1) 기-액 평형 조성
- 메탄올-물의 기-액 평형 관계
- 기-액 평형 : 두 성분이 혼합된 액체가 밀폐된 공간에 있다고 가정하고 이 공간에 열을 가하면 온도에 따라서 액상과 기상에 존재하는 물질의 양도 변하되고 액상과 기상을 이루는 성분들의 비도 달라진다. 이때 온도와 압력을 일정하게 하면 액상과 기상의 성분은 더 이상 변하지 않고 일정하게 되는 상태
- 메탄올과 물의 두성분계, 전압이 1atm, 액의 끓는점을
 , 용액 중의 메탄올의 몰 분율을
, 용액 중의 메탄올의 몰 분율을 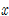 , 증기 중의 메탄올의 성분의 몰 분율을
, 증기 중의 메탄올의 성분의 몰 분율을  라 하면 이들 값 사이의 관계
라 하면 이들 값 사이의 관계
표 Ⅳ-1 메탄올-물계의 기액 평형(1atm)
|

|
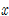
|

|
|
100
96.4
91.2
87.7
84.4
81.7
78.0
75.3
73.1
71.2
69.3
67.6
66.0
64.6
|
0
0.020
0.060
0.100
0.150
0.200
0.300
0.400
0.500
0.600
0.700
0.800
0.900
1.000
|
0
0.134
0.304
0.418
0.517
0.579
0.665
0.729
0.779
0.825
0.870
0.915
0.958
1.000
|
- 끓는점-조성 선도 : 메탄올-물계의 끓는점
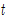 와
와 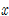 와
와
 와의 관계란 나타낸 그래프, 위의 선을
와의 관계란 나타낸 그래프, 위의 선을  곡선 또는 기상선, 아래선을
곡선 또는 기상선, 아래선을 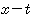 또는 액상선
또는 액상선
 선도 : 어떤 일정 온도에서
선도 : 어떤 일정 온도에서 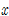 와
와 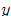 관계를 그린 그래프, 위의 곡선을
관계를 그린 그래프, 위의 곡선을  곡선(평형선)
곡선(평형선)

그림 Ⅳ-1 메탄올-물계의 끓는점 조성 선도 그림 Ⅳ-2 메탄올-물계의 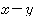 조성 선도
조성 선도
(2) 기-액 평형 조성에 대한 계산
- 상은 명확한 물리적인 경계를 가지고 다른 것과 구별되는 물질계의 균일한 한부분을 의미, 고상, 액상, 기상으로 구분
- 기-액 평형은 상평형의 하나로 그 계에 기체와 액체가 존재하는 경우, 두 상의 조성, 온도 압력이 일정하게 된 상태를 의미

- 액체 혼합물에서 한 성분이 나타내는 증기압은 그 온도에서 그 성분이 단독으로 존재할 때 나타내는 증기압에 용액 중에 존재하는 그 성분의 몰분율을 곱한 것과 같다.
- 순수한 두 성분
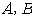 의 증기압을 각각
의 증기압을 각각 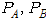 라 하고 액상 중의 저비점 성분
라 하고 액상 중의 저비점 성분  의 몰분율을
의 몰분율을 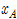 , 고비점 성분의
, 고비점 성분의 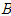 의 몰분율을
의 몰분율을  , 이 액체와 평형 상태에 있는 증기 중의
, 이 액체와 평형 상태에 있는 증기 중의 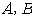 의 분압을 각각
의 분압을 각각 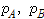 라하면
라하면
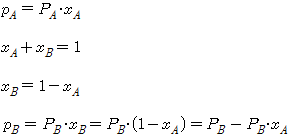


- 라울의 법칙을 나타낸 이 식들이 적용될 수 있는 범위는 극히 제한되어 있으나 증류 현상을 고찰할 때 가끔 사용
- 라울의 법칙을 따르는 용액을 이상 용액(ideal solution)

- 증기를 이상 기체라 가정하고 전체 압력
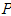 는 각 성분의 합과 같다.
는 각 성분의 합과 같다.

70 °C에서 메탄올의 증기압은 857 mmHg, 에탄올의 증기압은 543 mmHg이다. 이 두 화합물이 혼합되어 70 °C에서 전압 700 mmHg의 상태에 있을 때, 이 혼합액 중의 메탄올의 몰 분율(xA)은?(단, 이 혼합액을 이상 용액으로 간주한다.)








![]() 조성 선도
조성 선도
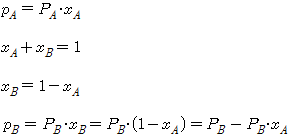
![]()
![]()

![]()
![]()
![]()
![]()


