


동기부여 영상 - 나 자신 ▶ Be Your Self(5분 13초)
![]()
 • 화합물이 어떤 결합의 원리로 형성되는지를 이해할 수 있다.
• 화합물이 어떤 결합의 원리로 형성되는지를 이해할 수 있다.
• 화합물을 이루는 결합의 종류와 그 특징을 설명할 수 있다.

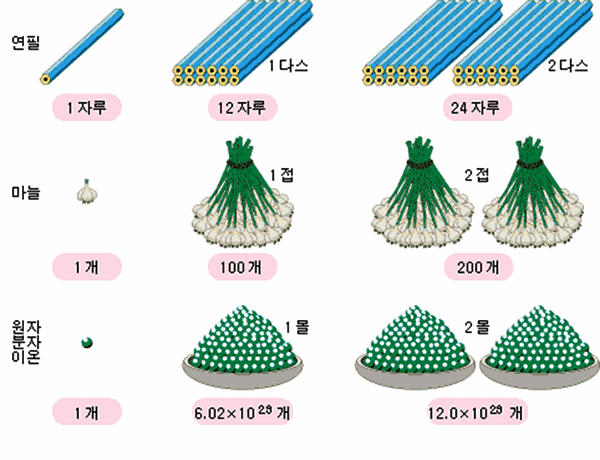
그림 I-24 다스와 몰


1. 암모니아(NH3) 4몰 중에는 수소원자가 몇 개 있는가?
2. 황 분자 속에는 황 원자가 8개 들어있다. 황 1mol 속에 들어있는 황 원자의 몰 수는 얼마 인가?

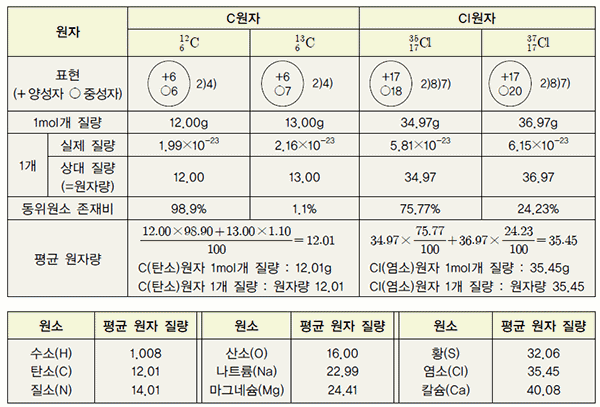
표Ⅰ-4 원소의 원자량(질량수와 거의 비슷하다.)

![]()
표 I-5 평균 원자량 구하는 방법 및 의미

3. 원자량이 12인 탄소 원자 1개의 질량은 1.99 × 10-23g이다. 원자량이 16인 산소 원자 1개 의 질량은 몇 g인가?



5. 다음 물질들의 분자량 또는 화학식량을 구하시오.(단, 수소의 원자량은 1, 질소의 원자 량 은 14, 산소는 16, 염소는 35.5, 칼슘은 40이다.)
1) 암모니아(NH3)
2) 오존(O3)
3) 설탕(C12H22O11)
4) 염화칼슘(CaCl2)
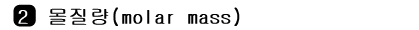
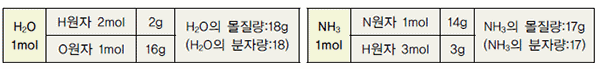
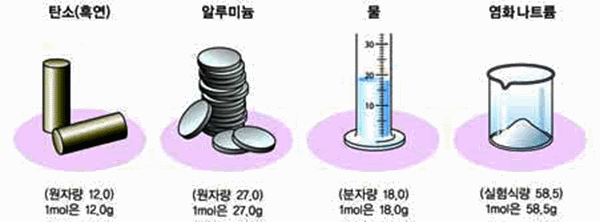
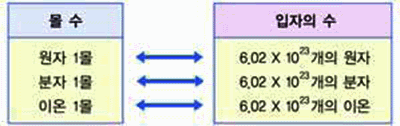
그림 I-25 원자나 분자를 아보가드로 수 만큼 모을 때 질량

원자, 분자, 이온과 같은 매우 작은 입자들을 나타낼 때는 어떻게 나타내는 것이 편리한지 탐구하기 위하여 각 질량에 해당하는 산소 원자의 개수를 계산해 보았다.
1. 산소 원자 1개의 질량이 2.66 × 10-23g이다.
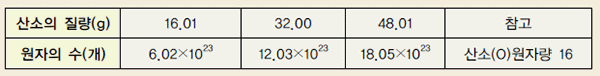
2. 물 분자 1개의 질량이 2.99 × 10-23g이다.


![]()
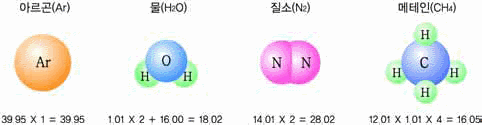
6. 다음 물질 1몰(mol)에 들어 있는 몰질량과, 각각 원자들의 총 몰 수를 구해 보자.
1) H2SO4
2) C2H4
3) C2H5OH
4) CH3COOH
7. 0℃, 1기압에서 0.5몰(mol)의 이산화 탄소(CO2) 기체가 있다.
1) 이산화 탄소 기체의 분자 수는 몇 개인가?
2) 산소(O) 원자는 몇 개인가?
3) 이산화 탄소의 질량은 몇 g인가?
[This is Arirang] Ssamji-gil Orchestra flash mob playing in Insa-dong