


어머니

 • 원자를 구성하는 입자의 종류와 성질을 설명할 수 있다.
• 원자를 구성하는 입자의 종류와 성질을 설명할 수 있다.
• 화합물의 명명법과 그 조성을 이해하고 설명할 수 있다.
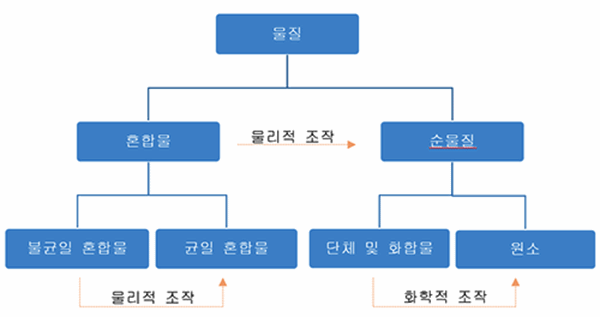
그림 Ⅰ-1 물질의 분류
예) 수소, 산소, 질소, 인, 황
예) 소금, 물, 설탕, 염화수소, 암모니아
예: 물은 1기압 조건에서 끓는점 100℃, 녹는점 0℃, 4℃에서 밀도 1.0g/㎤
(예: 수소 H, 나트륨 Na, 철 Fe)
예 : 물(H2O)은 수소(H)와 산소(O)로 이루어진 화합물, 염화나트륨(NaCl)은 나트륨(Na)과 염소(Cl)로 이루어진 화합물
예: 소금물은 1기압 조건에서 100℃에서 끓지 않고 0℃에서 얼지 않으며, 4℃ 조건에서 1.0g/㎤보다 큰 밀도를 갖는다.
균일 혼합물 (homogeneous mixture)
섞여 있는 물질들끼리 섞여 있는 정도가 일정한 혼합물
예) 설탕물, 공기, 소금물, 암모니아수
균일한 조성을 갖는다. 흔히 용액(solution)이라고 한다.
예: 공기는 질소(N2), 산소(O2) 및 다른 미량 기체들로 이루어진 기체 용액이다.
예: 술은 물과 에탄올, 기타 소량 물질들로 이루어진 액체 용액이다.
예: 치과용 아말감은 수은과 은, 기타 소량의 금속의 합금으로 고체 용액이며, 고용체(solid solution)라고 한다.
불균일 혼합물 (heterogeneous mixture)
섞여 있는 물질들끼리 섞여 있는 정도가 일정하지 않은 혼합물
예) 우유, 흙, 화강암, 석유(원유)
시멘트와 모래의 혼합물과 같이 성분들이 균일하게 섞여있지 않고 물리적으로 분리되어 있는 것을 말한다.
자연계에 존재하는 혼합물에서 불균일 혼합물이 균일 혼합물보다 훨씬 더 많다.
혼합물의 분리
물리적 조작을 통하여 두가지 이상의 물질로 나눌 수 있다.
이러한 조작을 분리(separation)라 하고, 특정한 물질만을 분리하는 것을 정제(purification)라고 한다.
여과, 증류, 크로마토그래피, 원심 분리, 재결정 등이 있다.
여과(filtration)
고체와 액체의 혼합물이나 고체와 기체의 혼합물을 여과재를 통해 기체나 액체만을 통과시켜 고체를 분리하는 방법
예: 거름종이가 끼워진 깔때기에 흙탕물을 부으면 흙과 물을 분리할 수 있다.
증류(distillation)
액체 혼합물을 가열하여 물질의 휘발성의 차이를 이용하여 각 성분을 분리하는 방법이다.
예: 바닷물을 끓여 물을 증발시키면 소금과 물을 분리할 수 있다.
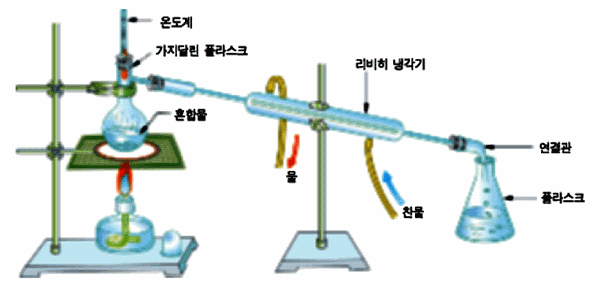
그림 Ⅰ-2 증류
크로마토그래피(chromatography)
액체나 기체 혼합물(이동상)을 특정 물질(고정상)을 채운 관으로 통과시켜 각 성분의 흡착 성질의 차이를 이용하여 분리하는 방법
원심분리
액체와 고체의 혼합물을 원심 분리기를 사용하여 분리하는 방법
재결정
용해도의 차를 이용하여 결정성 물질을 정제하는 방법이다.
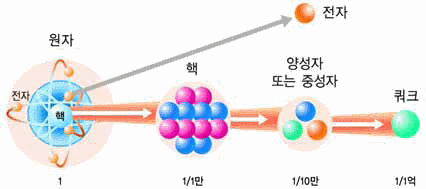
그림 Ⅰ-3 원자의 구성 입자

그림 Ⅰ-4 수소 원자 모형
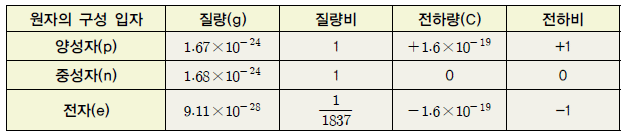
표Ⅰ-1 원자의 구성 입자들의 질량비와 전하



1. 다음의 각 원소의 질량수와 원자 번호를 구해 보자
|
구분 |
He |
Li |
Be |
F |
Ne |
|
양성자 수 |
2 |
3 |
4 |
9 |
10 |
|
중성자 수 |
2 |
4 |
5 |
10 |
10 |
|
원자번호 |
|||||
|
질량수 |
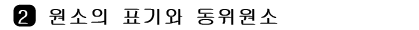
원소의 표기
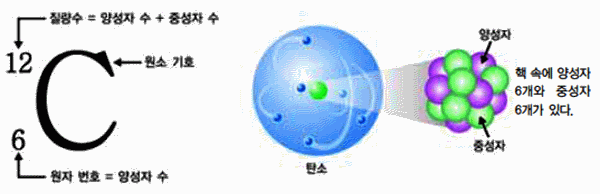
그림 I-5 ![]() 의 원소 표기와 모형
의 원소 표기와 모형
동위원소(isotope)
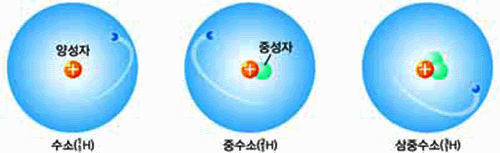
그림 I-6 수소의 동위원소

2. ![]() 의 양성자, 중성자, 전자의 개수를 구해 보자.
의 양성자, 중성자, 전자의 개수를 구해 보자.
원자량(atomic weight)
어떤 원소의 평균 원자 질량을 원자 질량 단위로 표시한 것
평균 원자질량: 자연에 존재하는 각 원소의 동위 원소의 구성비를 고려하여 계산한 원자의 평균 질량
원자 질량 단위(atomic mass unit): 질량수 12인 12C 원자 질량에 대한 상대적 값
12C 원자질량 : 12amu
1amu = (1/12)×1.99268×10-23g = 1.66057×10-24g
분자 (molecule)
독립적으로 존재하는 물질의 종류를 결정하는 최소 단위의 입자
같은 원소 또는 2가지 이상의 원소의 원자들로 구성되어 있는 집합체
같은 분자는 동일한 성질과 동일한 형태 및 크기를 가진다.
예 : 일원자 분자 헬륨, 이원자 분자 질소(N2), 다원자 분자 물(H2O), 고분자 PVC
분자의 모형
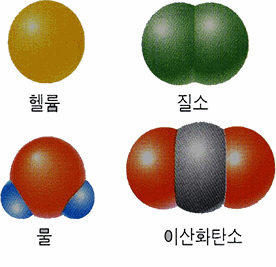
그림 I-7 분자의 모형
이온(ion)
전하를 띠고 있는 입자로 이루어진 원자나 원자단
원자가 전자를 잃어 양전하를 띤 이온을 양이온(cation), 전자를 얻어 음전하를 띤 이온을 음이온(anion)이라 한다
예 
염화나트륨은 같은 수의 Na+과 Cl-이 규칙적으로 배열하여 이온결정(ionic crystal)을 이루고 있다.
화학식(chemical formula)
분자식(molecular formula): 분자를 구성하는 원자의 종류와 수를 원소 기호를 사용하여 나타낸 화학식
예: 이산화탄소 CO2, 물 H2O
시성식: 분자 속에 들어있는 원자단을 구별하여 표시한 식
메탄올 CH3OH
구조식(structure formula): 분자를 구성하는 원자와 원자간의 결합 형태를 나타낸 화학식
실험식(empirical formula): 화합물의 조성을 가장 간단한 조성비로 나타낸 식
예: 과산화수소(H2O2)는 HO 로 표기함
분자의 화학식과 구조모형
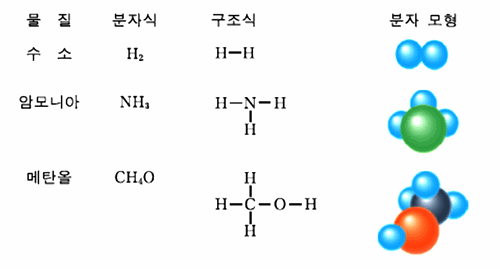
그림 I-8 분자의 화학식과 구조 모형
분자량과 화학식량
분자량: 분자를 구성하는 모든 원자들의 원자량의 합
예: 수소 분자(H2)분자량= 2×1.01amu = 2.02amu
화학식량: 화학식에 포함된 원자들의 원자량의 원자량 합
예: 염화나트륨(NaCl) = 23.0amu + 35.5amu = 58.5amu
이성분 화합물의 명명법
이성분 화합물은 화학식에서 뒤에 있는 원소 이름 끝에 ‘-화’를 붙인 다음 앞 에 있는 원소 이름을 붙인다.
다만, 수소를 제외한 산소나 염소 등과 같은 원 소의 이름이 ‘-소’로 끝나는 경우에는 ‘-소’를 생략한다
예) AgCl 염화 은 , MgO 산화 마그네슘, ZnS 황화 아연, CaH2 수소화 칼슘
Fe나 Cu 등의 금속 원소는 하나 이상의 전하를 가지며 이온을 형성한다
표Ⅰ-2 전하가 다른 이온을 가지는 원소
|
원소 |
낮은 전하 |
높은 전하 |
원소 |
낮은 전하 |
높은 전화 |
|
Cu |
Cu+ |
Cu2+ |
Pb |
Pb2+ |
Pb4+ |
|
Fe |
Fe2+ |
Fe3+ |
Cr |
Cr3+ |
Cr6+ |
금속과 비금속으로 형성된 화합물은 양이온의 산화수를 원소명 뒤의 괄호 안에 로마 숫자로 나타낸다.
예) FeCl2 염화 철(Ⅱ), FeCl3 염화 철(Ⅲ), Cu2O 산화 구리(Ⅰ), CuO 산화 구리(Ⅱ)
2개의 원소가 2개 이상 화합물을 형성하는 경우에는 혼동을 피하기 위하여 원자의 수를 일, 이, 삼 등으로 표시한다.
예) CO 일산화 탄소, CO2 이산화 탄소, SO2 이산화 황, SO3 삼산화 황
산으로 작용되는 이성분 화합물은 끝에 ‘-산’을 붙인다. HCN은 이성분 화합 물은 사이안화 수소산이라고 한다.
예) HCl 염화 수소산, H2S 황화 수소산, HBr 브로민화 수소산
일부 화합물은 관용명을 그대로 사용한다.
예) H2O 물, NH3 암모니아, N2H4 하이드라진 , PH3 포스핀
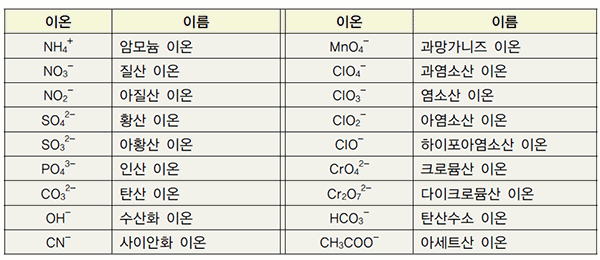
다원자 이온 결합 화합물의 명명법
몇 개의 원자가 결합하여 하나의 입자처럼 행동하는 이온을 다원자 이온이라고 한다. 표 I-3은 여러가지 다원자 이온을 나타낸 것이다.
표 I-3 여러 가지 다원자 이온
염의 화학식은 양이온을 먼저, 음이온을 나중에 쓴다. 이때 양이온의 전하량 과 음이온의 전하량은 같게 맞춘다. 읽을 때에는 음이온을 먼저 읽고, 양이온 은 나중에 읽는다.
예) Ca(NO3)2 질산 칼슘, (NH4)2SO4 황산 암모늄, Na2CO3 탄산 나트륨
산소를 포함하고 있는 산의 명명은 다음과 같이 나타낸다.
예) HNO2 아질산, HNO3 질산, H3PO4 인산, H2SO3 아황산, H2SO4 황산,
H2CO3 탄산, HClO 하이포아염소산, HClO2 아염소산, HClO3 염소산
HClO4 과염소산, H3BO3 붕산, CH3COOH 아세트산
수화물의 명명법
수화물은 화합물의 이름 다음에 포함하는 물 분자수에 ‘-수화물’을 붙이면 된다.
예) CuSO4·5H2O 황산 구리(Ⅱ) 오수화물, NaC2H3O2·3H2O 아세트산 나트륨 삼수화물

3. 다음 화합물을 명명해 보자.
1) H2SO4
2) NaOH
3) H2CO3
4) NH3
5) HBr
6) NO2
7) Cu2O
8) CaCl2·2H2O
(감동 이야기) 14개의 계단(6분 40초)